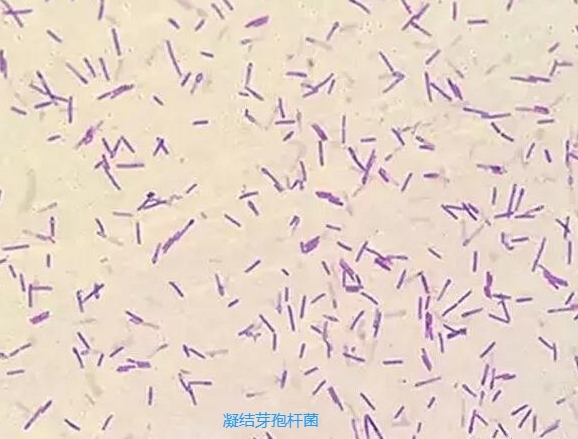
凝结芽孢杆菌(Bacillus coagulans)在发酵培养过程中能分解糖类生成乳酸,又称为芽孢乳酸菌,属于硬 ( 或厚) 壁菌门肠道乳酸菌,属于兼性厌氧型革兰氏阳性菌。胞体呈杆状,两端钝圆,单个、成对、少数呈短链状,芽孢端生,无鞭毛,可运动,菌落形态呈不透明白色。凝结芽孢杆菌可利用葡萄糖、木糖等产生 L-乳酸,具有乳酸杆菌和双歧杆菌等肠道主要有益菌相似的益生功能。最适生长温度为37 ~45 ℃,最适 pH 值为 6. 0 ~ 7. 0。
凝结芽胞杆菌的作用特点
凝结芽胞杆菌经口服进入胃后,由于胃的蠕动或机械运动,它们经过低 pH 的胃液及胃的内容物,开始被活化。

芽胞衣膨胀,芽胞形状增大,水含量增加,代谢速率加快。 从芽胞衣上长出突起,待凝结芽胞杆菌进入十二指肠时,孢子萌发形成营养细胞。
营养细胞而后进入小肠,并开始生长和繁殖。 大约每 30 分钟能繁殖一代,因而能产生大量地活菌。
它们能够在肠道内定居,并产生大量地抑制有害菌的凝固素(Coagulin)和 L(+ )乳酸,还产生 B 族维生素和各种消化酶,有益于营养的吸收。

凝结芽孢杆菌主要抑菌物质是有机酸和抗菌肽,对多种致病菌都具有杀菌活性[1]。凝结芽孢杆菌产生的乳酸可降低肠道 pH 值,抑制有害菌生长,对沙门氏菌有一定抑制作用(赵钰等,2015)[2]。
同时凝结芽孢杆菌的定植优化了肠道有益厌氧菌 ( 乳酸菌和双歧杆菌) 的生长环境,对游离氧的消耗,抑制了需氧的有害菌。从而调节了肠道微生物菌群的平衡。

凝结芽孢杆菌代谢过程中产生的物质有细菌素(Bacteriocin)、硫 肽(Thiopeptide)、内酯(Betalactone)、糖类(Saccharide)等。凝结芽孢杆菌分泌的细菌素是一种抗菌肽类物质,被称为凝固素(coagulin)。凝固素能够抑制沙门菌、小球菌等诸多致病菌的生长。凝固素(coagulin)的主要抑菌方式是增强膜的通透性,破坏膜质子动力势,并引起膜穿孔,导致细菌裂解死亡[3-4]。因此,凝固素(coagulin)不易使细菌产生广泛的耐药性,被认为是最具潜力的抗菌剂之一。
凝固素(coagulin)在 60 ℃ 能够稳定 90 min,在 pH 4 ~ 8 时保持稳定,不受 α 淀粉酶、脂酶或有机溶剂(10% 体积分数)的影响。 CLAIRE 等人在 2000 年测定了凝结素分子的一级结构区,这是一种由 44 个氨基酸残基组成的蛋白质[5]。
凝固素(coagulin)是由核糖体合成的抗菌肽[6]。细菌的细胞膜含有磷脂,其细胞壁呈酸性,这就使得带正电荷的、含有两性区或疏水区的凝固素(coagulin)能穿过靶细胞的细胞膜而杀死靶细胞。 这也就是产生细菌素的细菌能杀死其它细菌、抑制其它细菌生长的原因。

凝固素(coagulin)分子可以大致分为两个区域, 一个区域带有阳离子、具有亲水性、其 N 端高度保守;另一区域则是不太保守、具有疏水性或两性的 C端。 凝固素(coagulin)分子的 N 端和分子中间区域是折叠片。而折叠片由二硫键和两性的α螺旋所支持。
带有正电荷的、高度保守的 N 端折叠片通过静电反应,调节其与靶细胞表面的初始阶段的结合;而具有疏水性或两性的C端发卡样结构域则穿透靶细胞的细胞膜中疏水性区域[7] ,从而导致靶细胞膜的渗漏。一般情况下凝固素的一级结构区不稳定,但在疏水性的环境中可通过转换成高级结构区,保持一定的稳定性,从而发挥抑菌作用[8]。

凝固素(coagulin)二级结构区主要为α-螺旋、β-折叠、β-发夹结构(loop 结构区)及延伸结构(无序结构区)。α-螺旋型的 N 端和 C 端分别呈亲水性和疏水性, 形成了带正电荷的两亲性结构区, 这种结构区对破坏细菌细胞膜发挥着极其重要的作用[9-11]。分子内二硫键对凝固素(coagulin)结构的稳定性极其重要, 使其更易于穿过细菌的细胞膜[12]。正常情况下,凝固素(coagulin)并没有表现出统一的4种二级结构区,当凝固素(coagulin)与细胞膜接触进入与脂质结合的疏水部分才会表现出一些特定的二级结构[13-14]。
反向平行的β-折叠及分子内二硫键是此类抗菌肽的主要结构区特征。 分子内二硫键对凝固(coagulin)素结构的稳定性极其重要, 使其更易于穿过细菌的细胞膜[15]。

凝固素(coagulin)对不同致病菌的抑菌机理都是不同的,无论哪种机制都要经过吸引、附着、插入、定向几个过程,与细菌细胞进行接触。

α-螺旋型通常是凭借静电引力结合到细菌细胞膜上。其C端凭借疏水作用与磷脂结合,插入细胞质膜,使细菌细胞膜结构区破坏。 而且抗菌肽分子的单体会不断聚集,导致形成的离子通道孔径不断增大,使得内容物不断流出,最终致使细菌死亡[9-11,16]。β-折叠和β-发夹结构的抑菌机理与α-螺旋型相似,都是依赖于两亲性结构区特点,破坏细菌的细胞膜致其死亡[17]。

微生态益生菌制剂在畜牧业生产中应用日益广泛,然而对其抑菌代谢活性物质的研究还不够深入。随着细菌素分析提纯技术和分子生物学的不断发展,通过分子结构修饰改造提高其抑菌活性,稳定性及安全性,届时其在替抗中的应用将更加广泛。
参考文献
[1] 李刚 ,傅玲琳 ,王彦波. 益生菌凝结芽孢杆菌胞外产物抑菌特性研究[J]. 食品科技 , 2013, 38(10):20-24.
[2]赵钰, 傅玲琳, 王彦波. 凝结芽孢杆菌抑菌物质的理化特性研究[J]。食品研究与开发, 2015, 36(1): 20-25.
[3]杨昆,王欢,高洁,等.抗菌肽 BCp12 对大肠杆菌壁膜及DNA损伤的作用机制[J].食品科学,2021,42( 19) : 114 - 121.
[4]WANG Y,QIN Y X,ZHANG Y,et al. Antibacterial mechanism of plantaricin LPL-1,a novel class IIa bacteriocin against Listeria monocytogenes[J]. Food Control,2019,97: 87 - 93.
[5]CLAIRE LE MARREC, BERTRAND HYRONIMUS,PHILUOOE BRESSOLLIER,
etal. Urdaci biochemical and genetic characterization of coagulin,a new antilisterial bacteriocin in the pediocin family of bacteriocins,produced by Bacillus coagulans I4 [J] . Appl Environ Microbiol. 2000,66(12):5213-5220.
[6] Jack. RW,JR Tagg and B Ray. Bacteriocins of gram-positive bacteria
Microbiol[ J] . Rev.1995,59(2):171-200.
[7]LINE JNSEN,GUNNAR FIMLAND and JON NISSEN-MEYER. Thec-terminal Domain of pediocin-like antimicrobial peptides (class IIabacteriocins)Is involved in specific recognition of the c-terminal partof cognate immunity proteins and in determining the Antimicrobialspectrum J[ J] . Biol. Chem,2005,280(10):9243-9250.
[8] WANG G, LI X, WANG Z. APD3: the antimicrobial peptide database as a tool for research and education[J]. Nucleic Acids Research, 2016, 44(D1):D1087-D1093.
[9]MAHALKA A K, KINNUNEN P K J. Binding of amphipathic α-helical antimicrobial peptides to lipid membranes: Lessons from temporins B and L [J]。Biochimica et Biophysica Acta (BBA)-Biomembranes 2009, 1788(8): 1600-1609.
[10] TSENG T S, TSAI K C, Chen C. Characterizing the structure -function relationship reveals the mode of action of a novel antimicrobial peptide, P1, from jumper ant Myrmecia pilosula [J]。 Molecular Biosys tems, 2017, 13(6): 1193-1201.
[11] MASUDA R, DAZAI Y, MIMA T, et al. Structureactivity relationships and action mechanisms of collagen -like antimicrobial peptides [ J ] . Biopolymers,2017, 108(1): 453-459.
[12] SU Y, MANI R, DOHERTY T, et al. Reversible sheet-turn conformational change of a cell-penetrating peptide in lipid bilayers studied by solid -state NMR [J]。 Journal of Molecular Biology, 2008, 381(5): 1133-1144.
[13] SMITH V J, DESBOIS A P, DYRYNDA E A.Conventional and unconventional antimicrobials from fish, marine invertebrates and micro-algae[J]。 Marine Drugs, 2010, 8(4): 1213-1262.
[14]HANEY E F, HUNTER H N, MATSUZAKI K, etal. Solution NMR studies of amphibian antimicrobial peptides: Linking structure to function?[J]。 Biochimica et Biophysica Acta (BBA)-Biomembranes, 2009,1788(8): 1639-1655.
[15]SU Y, MANI R, DOHERTY T, et al. Reversible sheet-turn conformational change of a cell-penetrating peptide in lipid bilayers studied by solid -state NMR [J]。 Journal of Molecular Biology, 2008, 381(5): 1133-1144.
[16] CHEN Y, GUARNIERI M T, VASIL A I, et al.Role of peptide hydrophobicity in the mechanism of action of α-helical antimicrobial peptides [J]。 Antimicrobial Agents and Chemotherapy , 2007, 51 (4) :1398-1406.
[17] IMURA Y, NISHIDA M, MATSUZAKI K. Actionmechanism of PEGylated magainin 2 analogue peptide[J]。 Biochimica et Biophysica Acta (BBA) -Biomembranes, 2007, 1768(10): 2578-2585.
地址:上海市浦东新区川沙路1098号 电话:400-011-3626 邮箱:shjgsw2021@163.com 国际站网址: https://shjgsw.en.alibaba.com/
上海嘉冠生物科技有限公司 版权所有 Copyright © 20018-2028 All Rights Reserved 沪ICP备20018268号-1













